BILANGAN KUANTUM
Hipotesis Louis de Broglie dan azas
ketidakpastian dari Heisenberg merupakan dasar dari model Mekanika
Kuantum (Gelombang) yang dikemukakan oleh Erwin Schrodinger
pada tahun1927, mengajukan konsep orbital untuk menyatakan kedudukan
elektron dalam atom. Orbital menyatakan suatu daerah dimana elektron
paling mungkin (peluang terbesar) untuk ditemukan.
Persamaan gelombang (ψ=psi) dari Erwin
Schrodinger menghasilkan tiga bilangan gelombang
(bilangan kuantum) untuk menyatakan kedudukan (tingkat energi, bentuk,
serta orientasi) suatu orbital. Bilangan kuantum adalah suatu value
(nilai bilangan) yang menunjukkan keadaan/kedudukan elektron dalam suatu
atom.
Adapun 3 (tiga) bilangan kuantum yang
diusulkan oleh Erwin Schrodinger adalah, yaitu Bilangan Kuantum Utama
(n), Bilangan Kuantum Azimut (l), dan Bilangan Kuantum Magnetik (m)
a. Bilangan Kuantum Utama (n)
Menentukan besarnya tingkat
energi suatu elektron yang mencirikan ukuran orbital (menyatakan tingkat
energi utama atau kulit atom). Bilangan kuantum utama
memiliki harga mulai dari 1, 2, 3, 4,….dst (bilangan bulat positif).
Biasanya dinyatakan dengan lambang, misalnya K(n=1), L(n=2), dst.
Orbital–orbital dengan bilangan kuantum utama berbeda, mempunyai tingkat
energi yang berbeda. Makin besar bilangan kuantum utama, kulit makin
jauh dari inti, dan makin besar pula energinya. Hubungan antara kulit
dengan bilangan kuantum utama digambarkan sebagai berikut :
| KULIT | BIL.KUANTUM UTAMA (n) | SUB KULIT |
| K L M N Dst. | 1 2 3 4 … | 1s 2s, 2p 3s, 3p, 3d 4s, 4p, 4d, 4f … |
Menyatakan subkulit tempat
elektron berada. Nilai bilangan kuantum ini menentukan
bentuk ruang orbital dan besarnya momentum sudut elektron. Nilai untuk
bilangan kuantum azimuth dikaitkan dengan bilangan kuantum utama.
Bilangan kuantum azimuth mempunyai harga dari nol sampai (n – 1) untuk
setiap n. Setiap subkulit diberi lambang berdasarkan harga bilangan
kuantum l.
l = 0 , lambang s (sharp)
l = 1, lambang p (principal)
l = 2, lambang d (diffuse)
l = 3, lambang f (fundamental)
(Lambang s, p, d, dan f diambil dari
nama spektrum yang dihasilkan oleh logam alkali dari Li sampai dengan
Cs).
c. Bilangan
Kuantum magnetik (m)
Menyatakan orbital khusus
mana yang ditempati elektron pada suatu subkulit. Selain
itu juga dapat menyatakan orientasi khusus dari orbital itu dalam ruang
relatif terhadap inti. Nilai bilangan kuantum magnetik bergantung pada
bilangan kuantum azimuth, yaitu bilangan bulat dari –l sampai +l.
Contoh:
l = 0, maka nilai m = 0 berarti hanya
terdapat 1 orbital
l = 1, maka nilai m = –1, 0, +1, berarti
terdapat 3 orbital
Hubungan antara l dan harga m
digambarkan sebagai berikut :
| Harga l | Sub kulit | Harga m | Jumlah orbital |
| 0 1 2 3 | s p d f | 0 -1, 0, +1 -2, -1, 0, +1, +2 -3, -2, -1, 0, +1, +2, +3 | 1 3 5 7 |
d. Bilangan Kuantum Spin (s)
Bilangan kuantum ke-4 ini diusulkan oleh
George Uhlenbeck, Samuel Goudsmit Otto Stern, dan Walter
Gerlach pada tahun 1925. Bilangan kuantum spin terlepas dari
pengaruh momentum sudut. Hal ini berarti bilangan kuantum spin tidak
berhubungan secara langsung dengan tiga bilangan kuantum yang lain.
Bilangan kuantum spin bukan merupakan penyelesaian dari persamaan
gelombang, tetapi didasarkan pada pengamatan Otto Stern
dan Walter Gerlach terhadap spektrum yang dilewatkan
pada medan magnet, ternyata terdapat dua spektrum yang terpisah dengan
kerapatan yang sama. Terjadinya pemisahan garis spektrum oleh medan
magnet dimungkinkan karena elektron-elektron tersebut selama
mengelilingi inti berputar pada sumbunya dengan arah yang berbeda.
Berdasarkan hal ini diusulkan adanya bilangan kuantum spin untuk
menandai arah putaran (spin) elektron pada sumbunya.
Bilangan Kuantum Spin menyatakan
arah putar elektron terhadap sumbunya sewaktu elektron berputar
mengelilingi inti atom. Jadi, hanya ada dua kemungkinan arah
rotasi elektron, yaitu searah jarum jam dan berlawanan dengan arah jarum
jam, maka probabilitas elektron berputar searah jarum jam adalah ½ dan
berlawanan jarum jam 1/2 . Untuk membedakan arah putarnya maka diberi
tanda positif (+½) dinyatakan dengan arah panah ke atas dan negatif (–½ )
dinyatakan dengan arah panah ke bawah. Oleh karena itu dapat dimengerti
bahwa satu orbital hanya dapat ditempati maksimum dua elektron.
KONFIGURASI ELEKTRON BERDASARKAN KONSEP BILANGAN KUANTUM
Konfigurasi elektron
menggambarkan penataan/susunan elektron dalam atom. Dalam
menentukan konfigurasi elektron suatu atom, ada 3 aturan yang harus
dipakai, yaitu : Aturan Aufbau, Aturan Pauli, dan Aturan Hund.
1. Aturan
Aufbau
Pengisian orbital dimulai
dari tingkat energi yang rendah ke tingkat energi yang tinggi.
Elektron mempunyai kecenderungan akan menempati dulu subkulit yang
energinya rendah. Besarnya tingkat energi dari suatu subkulit dapat
diketahui dari bilangan kuantum utama (n) dan bilangan kuantum azimuth (
l ) dari orbital tersebut. Orbital dengan harga (n + l) lebih besar
mempunyai tingkat energi yang lebih besar. Jika harga (n + l) sama, maka
orbital yang harga n-nya lebih besar mempunyai tingkat energi yang
lebih besar. Urutan energi dari yang paling rendah ke yang paling tinggi
sebagaimana digaram yang dibuat oleh Mnemonik Moeler
adalah sebagai berikut:
1s < 2s < 2p < 3s < 3p <
4s < 3d < 4p < 5s < 4d < 5p < 6s < 4f < 5d ….
2. Aturan
Pauli (Eksklusi Pauli)
Aturan ini dikemukakan oleh Wolfgang
Pauli pada tahun 1926. Yang menyatakan “Tidak
boleh terdapat dua elektron dalam satu atom dengan empat bilangan
kuantum yang sama”. Orbital yang sama akan mempunyai
bilangan kuantum n, l, m, yang sama tetapi yang membedakan hanya
bilangan kuantum spin (s). Dengan demikian, setiap orbital hanya dapat
berisi 2 elektron dengan spin (arah putar) yang berlawanan. Jadi, satu
orbital dapat ditempati maksimum oleh dua elektron, karena jika elektron
ketiga dimasukkan maka akan memiliki spin yang sama dengan salah satu
elektron sebelumnya.
Contoh :
Pada orbital 1s, akan ditempati oleh 2
elektron, yaitu :
Elektron Pertama à n=1, l=0, m=0, s= +½
Elektron Kedua à n=1, l=0, m=0, s= – ½
(Hal ini membuktikan bahwa walaupun
kedua elektron mempunyai n,l dan m yang sama tetapi mempunyai spin yang
berbeda)
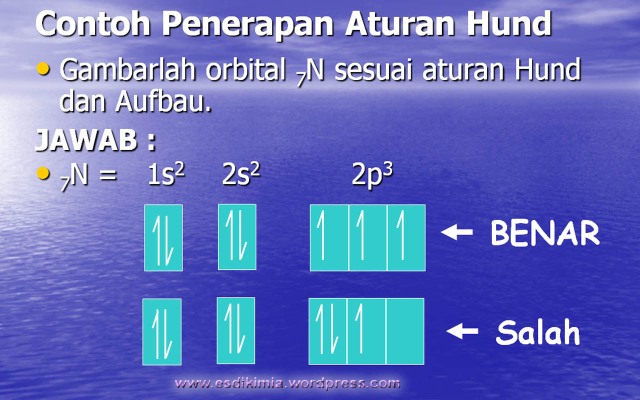
3. Aturan
Hund
Aturan ini dikemukakan oleh Friedrick
Hund Tahun 1930. yang menyatakan “elektron-elektron
dalam orbital-orbital suatu subkulit cenderung untuk tidak berpasangan”.
Elektron-elektron baru berpasangan
apabila pada subkulit itu sudah tidak ada lagi orbital kosong.
Untuk menyatakan distribusi
elektron-elektron pada orbital-orbital dalam suatu subkulit, konfigurasi
elektron dituliskan dalam bentuk diagram orbital.
Suatu orbital digambarkan dalam bentuk
kotak, sedangkan elektron yang menghuni orbital digambarkan dengan dua
anak panah yang berlawanan arah. Jika orn=bital hanya mengandung satu
elektron, maka anak panah yang ditulis mengarah ke atas.
Dalam menerapkan aturan hund, maka kita
harus menuliskan arah panah ke atas terlebih dahulu pada semua kotak,
baru kemudian diikuti dengan arah panah ke bawah jika masihterdapat
elektron sisanya.
- PRINSIP PENGGUNAAN ATURAN HUND
HUBUNGAN KONFIGURASI ELEKTRON DENGAN SISTEM PERIODIK UNSUR
Konfigurasi elektron menyatakan sebaran elektron dalam atom. Nomor atom menunjukkan jumlah elektron. Hal ini membuktikan bahwa terdapat hubungan antara sifat-sifat unsur dengan konfigurasi elektron, katena tabel Sistem Periodik Unsur (SPU) disusun berdasarkan kenaikan nomor atom unsur. Pada SPU dikenal istilah Golongan (kolom vertikal) dan Periode (baris horizontal)1. GolonganSPU dibagi atas 8 golongan. Setiap golongan dibagi atas Golongan Utama (A) dan Golongan Transisi (B). Penomoran golongan dilakukan berdasarkan elektron valensi yang dimiliki oleh suatu unsur. Setiap Unsur yang memiliki elektron valensi sama akan menempati golongan yang sama pulaBerdasarkan letak elektron terakhir pada orbitalnya, dalam konfigurasi elektron, unsur-unsur dalam SPU dibagi menjadi 4 blok, yaitu blok s, blok p, blok d, dan blok f.- Jika konfigurasi elektron berakhir di blok s atau p maka pasti menempati golongan A
- Jika konfigurasi elektron berakhir di blok d maka pasti menempati golongan B
- Jika konfigurasi elektron berakhir di blok f maka pasti menempati golongan B (Lantanida, n=6 dan Aktinida, n=7 (gol.radioatif))
Selain itu untuk menentukan nomor golongan, ditentukan dengan mengetahui jumlah elektron valensi pada konfigurasi terakhir.Contoh :11Na = 1s2 2s2 2p6 3s1Dapat diketahui bahwa elektron terakhir pada n=3 mempunyai elektron valensi 1, berarti golongan I serta berakhir di subkulit s, berarti Golongan A, jadi kalau digabungkan menjadi Golongan IA2. PeriodeSPU terdiri atas 7 periode. Periode disusun berdasarkan kenaikan nomor atom. Unsur-unsur yang mempunyai jumlah kulit sama akan menempati baris yang sama. Dengan demikian jumlah kulit sama dengan periode, sehingga periode 1 memiliki n-1, periode 2 memiliki n=2, dst.Contoh :11Na = 1s2 2s2 2p6 3s1Dapat diketahui bahwa elektron terakhir berada pada n=3 yang berarti unsur tersebut masuk dalam Periode3




0 komentar:
Posting Komentar